非小号app美国FDA(OTC)药品注册
管控,范围涵盖痤疮药物到手消毒产品。目前在美国市场上销售的OTC药物超过30万种,OTC产品在美国的医疗保健系统中扮演着越来越重要的角色。
❶新药物申请:是指活性成分的安全性和有效性是未知或未被认可的。这类产品在上市前需要获得FDA的预批准(pre-approval)。通过这个途径申请需要有完整的药物应用档案,包括临床试验,以证明其安全性和有效性。
❷OTC专论(OTC Monograph):是指活性成分通常被认为是安全有效的(Generally Recognized as Safe and Effective,GRASE)。专论中概述了对这类产品的限制,包括有效成分、标签以及其他的一般要求。如果产品符合专论中的要求,则不需要FDA的预批准。
一般来说,美国FDA会统一审查用于OTC药品的活性成分,并最终出具一份OTC专论(OTC Monograph)。
OTC专论就相当于活性物质标准。对于OTC产品,只要其中的活性成分满足OTC专论的要求,就可以不经FDA审批直接上市。
但需要注意的是,不用FDA审批并不意味着OTC药品上市没有任何合规义务,产品仍需要满足一定的要求,具体的要求如下:
OTC药品里的活性成分必须有现成的OTC专论,并且企业所用的活性成分符合OTC专论的要求,否则产品就要做OTC新药申请。
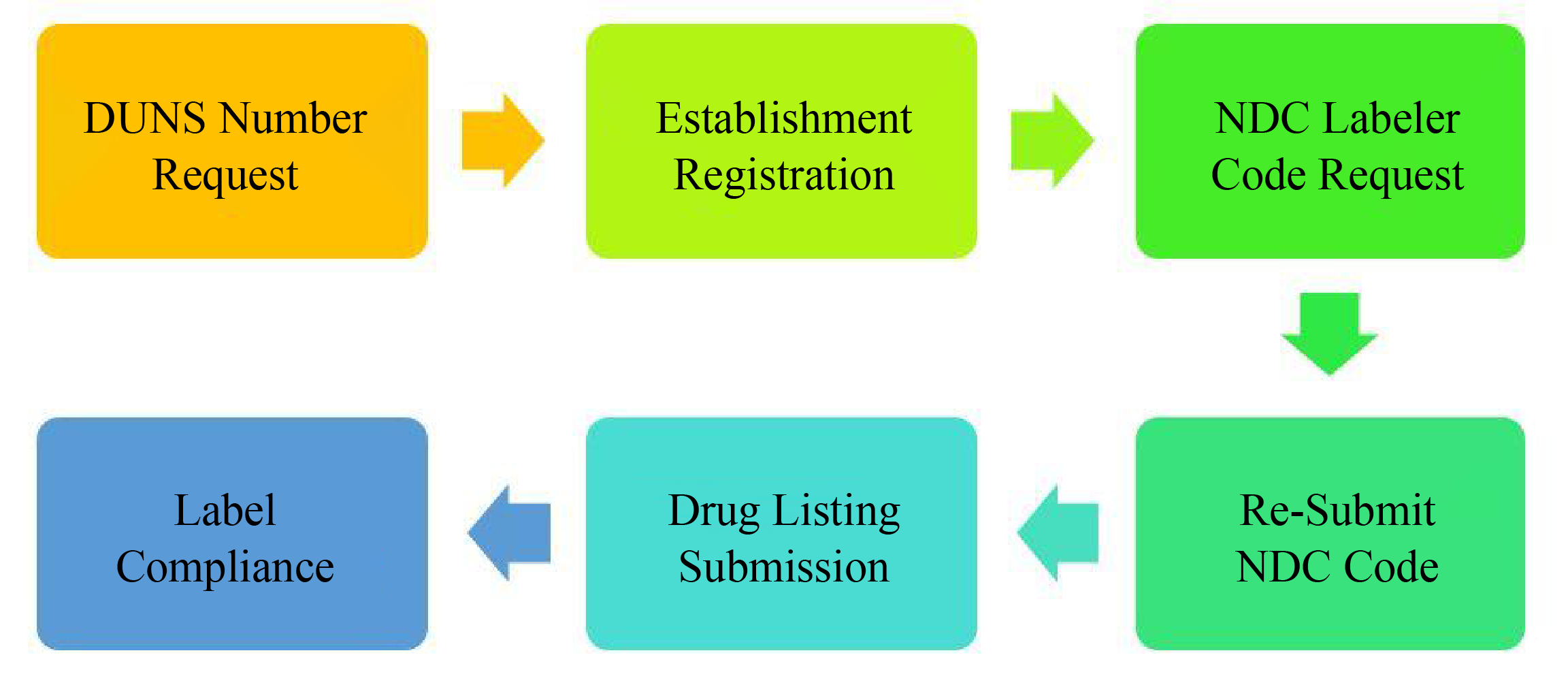
OTC药品的生产商或进出口商必须进行FDA厂址登记,对美国境外的企业来说,则需要委托美国境内的代理进行FDA厂址登记。
企业必须把将要进入美国市场的所有OTC药品列出清单并在FDA进行备份,之后此清单每年至少要在6月和12月更新两次。
基于健康的暴露限度(HBEL)评价及计算方法详解,全面掌握HBEL评价流程及应用
为您提供行业最新动态,解析市场发展趋势,共享优质免费资源,助力企业合规发展!
OEL可以推导计算PDE吗?PDE与OEL有什么区别?适用范围有哪些?
详解|药品PDE可以自己计算吗?PDE数据查询哪里找?评估报告有何要求?
CDE发布征求《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征求意见稿)》通知
CDE官方正就《原发性胆汁性胆管炎治疗药物临床试验技术指导原则》征求意见中
浙江省杭州市余杭区龙舟北路76号浙江大学校友企业总部经济园二期 中心智慧楼C1幢10层 (311121)
猜你喜欢
- 06-03非小号多名大佬宣布退出币圈!
- 06-12非小号滴滴(OTC)(ADR)(DIDIYUS)3月
- 06-10非小号腾讯健康上新功能:仅需
- 06-18非小号滴滴(OTC)(ADR)(DIDIYUS)2月
- 06-09非小号四问稳定币
- 05-17非小号新闻深度天极资讯频道_
- 02-13非小号孙宇晨引领波场TRON迈进
- 05-17非小号加密货币集体异动以太坊
- 12-07非小号雷蛇发布Gaiadex:矿物级
